O novo link de acesso para o cardiopapers:
O novo link de acesso para o cardiopapers:
Tandem Heart – a luz no fim do túnel do choque cardiogênico refratário?
7 fev
Já publicamos aqui no Cardiopapers uma breve revisão sobre o dispositivo Tandem Heart. Esta semana no jacc saiu um artigo muito interessante mostrando uma situação em que esse dispositivo pode ser de fundamental importância. No estudo foram avaliados 117 pacientes com quadro de choque cardiogênico refratário ao uso de balão intra-aórtico. Destes 80 tinham cardiopatia isquêmica e 37 cardiopatia não isquêmica. Quase metade dos pctes tinham recebido reanimação cardiopulmonar logo antes ou mesmo durante a implantação do equipamento. Ou seja, a gravidade dos casos era incrivelmente grande.
O que se observou foi:
– O índice cardíaco médio aumentou de 0,5 para 3 L/(min.m2)
– a pressão arterial média subiu de 70 para 100 mmHg
– a SvO2 aumentou de 49 para 69,3%
– o débito urinario aumentou de 70 mL/dia para 1.200 mL/dia
– A creatinina caiu de 1,5 para 1,2
– o lactato caiu de 24 para 11
– a PAPO caiu de 31 para 17.
Ou seja, todos os parâmetros de micro e macrohemodinâmica avaliados melhoraram. Bem, mas isto não significaria muito coisa se os pctes não tivessem de fato tido um desfecho melhor (todos os parâmetros acima são chamados de surrogate end points, não são desfechos “duros”). O que se viu é após 30 dias 60% dos pctes estavam vivos. Após 6 meses este número caiu para 55%. No estudo todos os pctes eram submetidos a intervenção. Como não há grupo controle não se pode falar que houve diminuição de mortalidade de tal magnitude. Mas os médicos que manejam pacientes com choque cardiogênico no dia-a-dia sabem que certamente a mortalidade deste grupo de pacientes tende a ser bem maior do que a observada no estudo.
Referência: Kar B, Gregoric I, Basra S, et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. J Am Coll Cardiol 2010; DOI:10.1016/j.jacc.2010.08.613.
Macrolídeos + antagonistas dos canais de cálcio – risco de hipotensão grave
7 fev
Os antibióticos eritromicina e claritromicina ao serem utilizados em associação a antagonistas de canais de cálcio geram um risco alto de hipotensão importante, relata um estudo publicado recentemente no Canadian Medical Association Journal. O dado é de especial interesse para os cardiologistas uma vez que boa parte de seus pacientes estão em uso de antagonistas do cálcio por diversas indicações (controle de PA, angina, taquiarritmias, etc). Além disso, os macrolídeos são extensamente usados na prática clínica em especial para o tratamento de infecções respiratórias como pneumonia.
A hipótese de que poderia haver este risco quando do uso combinado das medicações veio do fato dos macrolídeos sabidamente inibirem o citocromo P450 (sempre ele) o qual é responsável pela metabolização dos antagonistas do cálcio. Com o citocromo inibido, os níveis séricos dos antagonistas do cálcio tendem a ficar bastante elevados, assim aumentando o risco de efeitos adversos como hipotensão.
Através de uma série de análises os pesquisadores chegaram a conclusão de que a eritromicina aumenta em 5,8 vezes o risco de hipotensão grave quando combinada com antagonistas do cálcio. Já com a claritromicina o aumento é de 3,7 vezes.
A boa notícia é que há boas alternativas nestes casos. O trabalho mostrou que a azitromicina não aumenta o risco de hipotensão. Isto também já era esperado uma vez que a mesma não atua no bendito P450. Por ter a mesma eficácia antimicrobiana que a claritromicina além de ser tomada apenas 1x ao dia (a claritromicina deve ser administrada a cada 12 horas) a azitromicina revela-se uma alternativa melhor para o tratamento de infecções respiratórias no cardiopata em uso de antagonistas do cálcio.
Resumindo:
– claritromicina + antagonistas do cálcio = risco de hipotensão grave/choque
– azitromicina + antagonistas do cálcio = tratamento eficaz sem risco de hipotensão
Referência: Wright AJ, Gomes T, Mamdani MM, et al. The risk of hypotension following co-prescription of macrolide antibiotics and calcium-channel blockers. CMAJ 2011; DOI:10.1503/cmaj.100702.
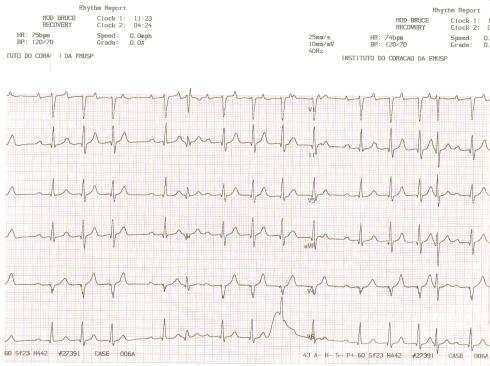
Qual a causa da síncope deste paciente?
4 fevPaciente do sexo masculino, de 69 anos, procurou o pronto-socorro com história de síncope aos esforços.
Antecedentes pessoais: hipertensão, ex-tabagista, IAM prévio em 1992. Apresenta, ao ecocardiograma, FE 45%, com acinesia inferior.
A imagem do teste de esforço encontra-se abaixo:
CLIQUE NO LINK ABAIXO PARA DISCUSSÃO
Complicações Vasculares Locais nos Cateterismos Cardíacos
4 fevRotineiramente temos contato com paciente proveniente da sala de hemodinâmica onde foram submetidos aos mais diversos procedimentos através do cateterismo. Portanto é importante o conhecimento das complicações vasculares deste procedimento.
Dentre todas as intercorrências inerentes ao cateterismo cardíaco, as complicações vasculares são as mais comuns. Dentre eles podemos citar :
- Hemorragias e hematomas locais e retroperitoneais;
- Trombose aguda (principalmente acesso radial);
- Embolização Distal;
- Dissecções ;
- Pseudoaneurismas;
- Fístulas Arterio venosas (FAV).
Dica prática: Hematomas e Hemorragias apresentam-se precocemente (em até 12 horas), já pseudoaneurisma e Fístulas Arterio Venosas podem aparecer de dias a semanas após o procedimento.
Para identificação de tais complicações é importante, sempre após a chegada do paciente na unidade , a avaliação cuidadosa do sítio de punção em busca de abaulamentos e sopros, além de palpação meticulosa dos pulsos distais.
Hematoma: É caracterizado por sangramento em partes moles da coxa. Clinicamente apresenta-se através de dor e desconforto local associado a equimose. Resolve-se em dias a semanas sem maiores consequências. Pode comprimir o nervo femoral resultando em fraqueza da musculatura do quadríceps.
Fatores de risco: Idade avançada; sexo feminino; Baixo peso ( IMC), uso de anticoagulante e inibidores da Glicoproteína IIb/IIIa.
Tratamento: Em caso de progressão, realizar nova compressão manual ou com dispositivos. Reversão de anticoagulação e antiagregação com ressalvas e em casos selecionados.
Hematoma Retroperitoneal: Relacionado à punções acima do ligamento inquinal, à múltiplas punções, e à punções na parede posterior do vaso. Pode se manifestar por dor em flanco e hipotensão com sinais de colapso circulatório com queda inexplicada de Ht.
Diagnóstico: Tomografia computadorizada. Na sua falta, pode-se utilizar o USG doppler.
Tratamento: Conservador, com reposição volêmica e de hemoderivados, geralmente não sendo necessário cirurgia. Se paciente ainda com introdutor, retirar e compressão prolongada.
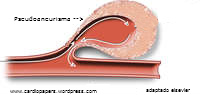
Pseudoaneurisma: É uma das complicações mais comuns (0,05% a 2%). É um hematoma contido por partes moles do tecido perivascular que mantém continuidade com lúmen arterial passando a desenvolver fluxo entre o hematoma e a artéria (não existe endotélio no pseudoaneurisma). Apresenta-se com dor, sopro sistólico no sítio de punção , massa pulsátil e hematoma em expansão, podendo haver redução de de força no membro inferior por compressão nervosa. A maioria é evidenciada nos 3 primeiros dias após a retirada do introdutor e o restante em até 7 dias.
Fatores de Risco: Principal fator de risco é técnica e tempo de compressão na retirada inadequados. Outros fatores de risco são idade > 65a, obesidade, múltiplas punções, introdutores calibrosos, intervenções complexas, anticoagulação e antiagregação, punção da arteria femoral superficial ao invés da arteria femoral comum, hipertensão não controlada.
Diagnóstico: USG doppler
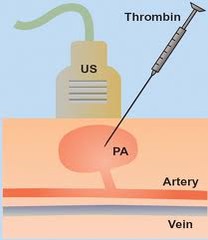
Tratamento: A injeção de trombina guiada por ultrassom é a conduta mais adequada para a maioria dos pseudoaneurismas (sucesso em até 94%) com objetivo de trombose localizada do pseudoaneurisma. Compressão guiada por ultrassom pode falhar em até 15 % dos casos. Cirurgia é indicada quando se torna tão grande que pode gerar necrose da pele superficial por tensão ou comprimir vasos e nervos; infecção local e na falha dos procedimento minimamente invasivos. Em raros casos, pseudoaneurismas de <2cm ter conduta expectante (fechamento espontâneo).
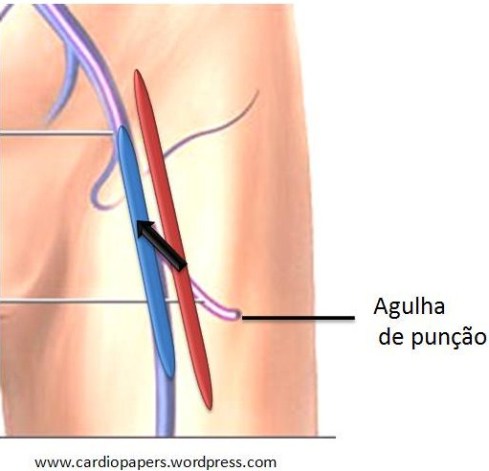
Fístula Arterio venosa: Ocorre quando a agulha de punção transfixa a artéria e a veia femoral seguida de dilatação com a bainha/introdutor, ocasionando um fluxo continuo entre as duas estuturas. A Literatura traz uma incidência de 0,11% a 016% nos cateterismos diagnósticos e em até 0,87% nas intervenções coronárias percutâneas. Manifesta-se por sopro contínuo no sítio de punção ( no pseudoanurisma o sopro é sistólico), expansão do hematoma redução ou ausência dos pulsos distais, massa pulsátil.
Fatores de Risco: Punção abaixo da arteria femoral comum, introdutores calibrosos, idade avançada, e terapia trombolítica.
Diagnóstico: USG Doppler
Tratamento: FAV pequenas e assintomáticas podem ser acompanhadas com acompanhamento rigoroso por USG (não mais do que 2-4 semanas). A maioria, no entanto, necessita de reparação cirúrgica já que tende aumentar com o tempo.
REFERÊNCIAS:
http://www.uptodate.com/ (Joseph P Carrozza, MD Complications of diagnostic cardiac catheterization – setembro de 2010)
– Aviles, Ronnier J.; Askari, Arman T.; Messerli, Adrian W.; Penn, Marc S.; Topol, Eric J. Title: Introductory Guide to Cardiac Catheterization, 1st Edition
Hiperaldosteronismo primário: quem investigar e como fazer um screening adequado
3 fev

Hiperaldosteronismo primário é a principal causa de hipertensão secundária. Recentes estudos prospectivos mostram que pode corresponder a 10% de todos os hipertensos, embora esse número possa estar superestimado por um viés de seleção de centros especializados em HAS.
Hipocalemia só está presente em 9-37% dos pacientes, assim não se deve esperar esse achado para inciar a investigação
#Quem devo investigar?
– pacientes hipertensos estágios 2 e 3 ou com HAS resistente a medicações
– HAS + hipocalemia espontânea ou induzida por diuréticos
– HAS com incidentaloma adrenal
# Como devo investigar?
– O exame laboratorial de screening é a relação aldosterona dividido por atividade plasmática de renina (APR). O screening é positivo quando essa relação é > 30. Alguns autores consideram como achado adicional que fortalece o diagnóstico a presença de aldosterona >15.
# O que devo fazer para que o exame de screening seja válido?
– Corrigir hipocalemia. A hipocalemia bloqueia a aldosterona levando a valores falsamente negativos de aldo/APR
– Como regra geral a maiora dos antihipertensivos (iECA, bloq AT1, diureticos) leva a relação falsamente baixa de aldo/APR porque desbloqueia a renina. Beta-bloqueadores levam a relação falsamente alta porque bloqueiam renina.
– Medicações que devem ser suspensas 4 semanas antes do screening: diuréticos, antagonistas da aldosterona
– Medicações que devem ser suspensas até 2 semanas antes: iECA, bloqueadores ATI, betabloqueadores e AINES
– Medicações antihipertensivas que podem ser mantidas: verapamil hidralazina, alfa bloqueadores
É importante ter bom senso na suspensão dessas medicações, assim se o paciente tem insuficiência cardíaca que precisa fazer uso de diuréticos o mais adequado é manter a medicação e fazer a relação aldo/APR assim mesmo. Uma vez que os diuréticos costumam liberar a APR e dar resultados falso-negativos se o resultado vier positivo (>30 ) já é mais que suficiente para confirmar o screening positivo.
Lembrar que isso é só screening. Há vários outros passos a serem feitos para confirmar o diagnóstico. Após screening positivo encaminhar a endocrinologista ou especialista em HAS.
Referência: Case detection, Diagnosis and Treatment of Patients with Primary Aldosteronism: An Endocrine Society Clinical Practice Guideline
Hidroclorotiazida – droga de primeira linha para hipertensão?
30 janSempre acreditou-se no uso de tiazídicos como droga de primeira linha para tratamento da hipertensão (HA). Em 97% dos casos, a droga escolhida é a hidroclorotiazida (HCT), nas doses de 12,5 a 25mg por dia. Em 2008, nos Estados Unidos, mais de 134 milhões de prescrições foram feitas com HCT (um terço em monoterapia). A segunda droga mais prescrita foi o atenolol, com 44 milhões de prescrições.
Uma meta-análise publicada recentemente no Journal of the American College of Cardiology (JACC) comparou o efeito de diversas drogas anti-hipertensivas na pressão arterial (PA) em 24hs. A queda da PA sistólica e diastólica com o uso de HCT 12,5 a 25mg foi significamente menor quando comparado a inibidores da ECA, bloqueadores do receptor de angiotensina, betabloqueadores e bloqueadores do canal de cálcio. Já quando comparamos essas drogas com HCT 50mg/dia, não houve diferença estatística.
Mas ao utilizar altas doses de HCT, é mais comum a ocorrência de efeitos colaterais, tais como hipocalemia, hiponatremia, hiperuricemia e resistência à insulina. Além disso, não há evidências que o uso de HCT nas doses habituais (12,5 a 25mg/dia) possam reduzir desfechos como IAM, AVC ou morte. Todos estudos que mostraram benefício em algum desses desfechos foram realizados ou com doses maiores de HCT ou com outro tiazídico, como a clortalidona ou a indapamida.
Resumindo, a eficácia anti-hipertensiva da HCT nas doses 12,5 e 25mg diárias é consistentemente inferior quando comparada com outras classes de drogas. Assim, a HCT nessa dose não deve ser utilizada como primeira linha no tratamento da HA. Se optar pelo uso de algum tiazídico, preferir clortalidona ou indapamida.
Referência: Messerli FH, Makani H, Benjo A, Romero J, Alviar C, Bangalore S. Antihypertensive efficacy of hydrochlorothiazide as evaluated by ambulatory blood pressure monitoring. J Am Coll Cardiol 2011;57:590-600.
Pcte com ICC e DPOC: usar ou não betabloqueador?
29 jan
DPOC e ICC são doenças que frequentemente coexistem. Até 30% dos pacientes com ICC possuem DPOC associado. A associação comumente leva aos médicos a deixarem de prescrever betabloqueadores a este grupo de pacientes, temendo que a medicação cause exacerbação da doença pulmonar.
Alguns pontos relevantes sobre o assunto são:
– o uso de betabloqueadores B1 seletivos (como metoprolol) já foi avaliado em vários estudos pequenos que não mostraram piora dos sintomas de DPOC nem aumento das internações por exacerbação da doença.
– o uso de betabloqueadores não seletivos e com bloqueio alfa combinado (ex: carvedilol) foi menos estudado mas também mostrou-se seguro nesta população de pctes.
– Em pctes com IAM recente e com DPOC, o uso das medicações citadas acima diminuiu mortalidade e não aumentou a taxa de internações por DPOC exacerbado.
– Apesar dos betabloqueadores, mesmo que seletivos, poderem comprovadamente causar exacerbação dos sintomas no início do tratamento já está demonstrado que este efeito tende a diminuir com o tempo de uso da medicação. Assim, mesmo em pctes que apresentam piora do broncoespasmo nos primeiros dias/semanas de uso do betabloqueador deve-se tentar manter a medicação por um tempo mais prolongado.
– Um artigo de revisão do jacc propõe o seguinte esquema em pctes com ICC e DPOC:
1- Pctes com DPOC que não possuem componente obstrutivo reversível importante – usar carvedilol ou metoprolol
2- Pctes com DPOC que possuem componente obstrutivo reversível importante – preferir agente beta1 seletivo (ex: metoprolol)
3- Pcte com DPOC exacerbado – evitar o uso de betabloqueador
Referência: Jemtel THL e cols. Diagnostic and therapeutic challenges in patients with coexistent Chronic Obstructive Pulmonary Disease and Chronic Heart Failure. Jacc Vol. 49, No 2, 2007. January
AVC no perioperatório de revascularização miocárdica: quais os fatores de risco? o que fazer para evitar?
27 jan
AVCi é uma complicação temida no período perioperatório de revascularização miocárdica. Em trabalhos publicados previamente notou-se que a maior causa de isquemia cerebral neste contexto são êmbolos de colesterol provenientes da aorta calcificada. Muitas estratégias vem sendo exploradas para diminuir este risco.
Um estudo publicado na edição do dia 26 de janeiro do JAMA revela a experiência da Cleveland Clinic em relação ao assunto. Foram analisados 45.432 pctes que foram submetidos a cirurgia de revascularização miocárdica de 1982 a 2009, sendo registrado a ocorrência de AVCi no perioperatório e os fatores de risco relacionadas com a morbidade.
Pontos importantes do estudo:
– a técnica cirúrgica com menor risco de AVCi foi a revasc sem CEC, seguida pela com CEC com técnica do beating-heart (na qual não se faz parada cardíaca induzida). Já na técnica com CEC mas com parada induzida, principalmente se associada com hipotermia, houve aumento do risco de isquemia cerebral.
– o surgimento do AVC foi classificado em 2 períodos – intra-operatório quando o pcte acordava da anestesia já com déficit neurológico e pós-operatório quando ele acordava sem déficit e o desenvolvia posteriormente. Interessante foi que a maioria dos eventos ocorreu no período pós-operatório (58% do total). Motivo?? Questiona-se que o período de maior coagulabilidade/maior inflamação no pós-operatório possa explicar isto.
– O pico de AVC no pós-operatório ocorreu com 40h após o término da cirurgia
– Fatores de risco para AVC intra-operatório – presença de doença vascular periférica ou de doença carotídea, disfunção de VE, presença de lesão de Cx >70%, cirurgia com CEC e parada circulatória.
– Fatores de risco para AVC pós-operatório – idade avançada, AVCi prévio, lesão de tronco de coronária esquerda, diabetes, entre outros.
– A ocorrência de FA aguda no pós-operatório não foi fator de risco para AVC. Deve-se comentar contudo que no serviço estudado há a rotina de se tentar cardioverter toda FA aguda neste cenário (ou por medicamentos ou por CVE). Apenas nos casos em que não se consegue reversão para ritmo sinusal é que se opta por controle da FC e anticoagulação. Isto pode ter ajudado para o fato de FA nova não ter aumentado o risco de AVC.
– A técnica com CEC produz revascularização mais completa, contudo às custas de maior risco de AVC. Já a técnica sem CEC traz menos risco de AVC mas sem produzir revascularização tão completa. O que os autores sugerem é que se escolha a técnica cirúrgica baseada no perfil do pcte. Caso seja um pcte jovem, com lesões coronarians difusas e sem aterosclerose aórtica importante o mais racional seria fazer cirurgia com CEC – o risco de AVCi do pcte já é pequeno no período perioperatório e ele se beneficiaria bastante de revascularização completa. Já em um pcte idoso, com “aorta em porcelana” (muito calcificada), com lesão complexa de DA proximal e e de Cd não dominante talvez fosse mais interessante fazer uma revasc sem CEC colocando mamária-DA e deixando a Cd sem intervenção ou mesmo abordar de forma percutânea posteriormente esta lesão.
Referência: Tarakji K, Sabik J, Bhudia S. Temporal onset, risk factors, and outcomes associated with stroke after coronary artery bypass grafting. JAMA 2011; 305:381-390.
Tratamento percutâneo de insuficiência mitral: quais as opções?
26 jan
Cada vez mais os métodos intervencionistas percutâneos vêm apresentando inovações surpreendentes. Ano passado o trial PARTNERS mostrou a relevância do implante percutâneo de prótese aórtica em pacientes com estenose aórtica crítica mas sem condições de realizar cirurgia cardíaca. Agora o tratamento através de catéter da insuficiência mitral também vem ganhando espaço na literatura.
Existem duas formas de se corrigir, ao menos parcialmente, a insuficiência mitral através do cateterismo. A primeira é através da anuloplastia do anel mitral e a segundo através do reparo da cúspide. Enquanto a anuloplastia é usada basicamente para insuficiência mitral funcional (aquela secundária a dilatação do ventrículo esquerdo), o reparo percutâneo da valva mitral é mais usado para os casos de prolapso da cúspide posterior da mitral.
A anuloplastia pode ser realizada de forma indireta ou de forma direta. Na forma indireta punciona-se a veia jugular interna e introduz-se um catéter até o seio coronário. Este envolve cerca de 2/3 da circunferência do anel mitral. Ao colocar-se um dispositivo de metal no seio coronário que “aperta” o anel mitral, consegue-se diminuir o diâmetro do mesmo, consequentemente diminuindo o grau de regurgitação mitral. Um problema deste método é que ele pode causar compressão da artéria circunflexa. Assim, é importante a realização de cate esquerdo após a colocação do dispositivo para avaliar esta artéria.

Já na forma direta de se realizar a anuloplastia realiza-se uma punção arterial, introduzindo-se um catéter até o ventrículo esquerdo de forma retrógrada. Lá chegando, coloca-se uma série de “âncoras” ao redor do anel mitral. Essas âncoras são posteriormente ligadas entre si por um fio que causa tensão ao redor do anel mitral, diminuindo assim o seu diâmetro. A vantagem deste método é o fato de não causar compressão coronariana.
Por fim, a forma de se realizar reparo da cúspide de forma percutânea é demonstrada na primeira figura deste tópico. O que se faz é colocar um clip que liga as pontas das duas cúspides da valva mitral, formando assim uma nova estrutura com 2 orifícios ao invés de um. Neste método realiza-se uma punção venosa, chegando-se ao átrio esquerdo através de uma punção transeptal do átrio. O procedimento é guiado por fluoroscopia e pelo eco TE. Uma possível complicação deste método é diminuir demasiadamente a área valvar mitral, gerando assim uma estenose mitral funcional. Assim recomenda-se que esta técnica seja aplicada apenas nos casos em que a área valvar mitral antes do procedimento seja >4 cm2.
Referência: Feldman T, Cilingiroglu M. Percutaneous Leaflet Repair and Annuloplasty for Mitral Regurgitation. JACC vol 57, No 5, 2011. February 1, 2011: 529-37.
SHOCK Trial :SHould We Emergently Revascularize Occluded Coronaries for Cardiogenic ShocK
25 janDa Série dos grandes estudos, o Shock Trial veio para mudar paradigmas. Em 26 de agosto de 1999, este estudo randomizado multicêntrico foi publicado na New England Journal Of Medicine e fazia parte de um conjunto da publicaçõe SHOCK Trial Study Group. Temporalmente foi realizado em uma época em que o choque cardiogênico era a principal causa de óbito dentre os pacientes hospitalizados e apresentava altas taxas de mortalidade( 70-80%).
O estudo incluiu 302 pacientes em choque devido, principalmente, disfunção ventricular esquerda secundário a infarto agudo do miocárdio, comparando uma estratégia de revascularização de emergência ( 152 pcts) versus uma conduta inicial de estabilização clínica do paciente ( 150pcts).
Apenas pacientes com choque cardiogênico com predominância de disfunção venricular esquerda secundária a IAM com Supra de ST ou presença de novo BRE foram incluídos.
Choque Cardiogênico foi caracterizado por critérios clínicos e hemodinâmicos que são importantes para compreensão da validade do estudo.
Clínicos:
- PAS<90mmhg por 30 min antes do início de inotrópicos/ vasopressores OU inotrópicos ou balão intra aórtico são necessários para manter a PAS >=90mmhg
- Evidência de redução da perfusão tecidual ( Ex. Débito urinário<=30ml/h ou extremidades frias e mal perfundidas)
- FC>= 60bpm
Hemodinâmicos:
- Pressão de Arteria Pulmonar Ocluída >=15mm/hg
- Índice Cardíaco<=2,2 L/min/m2
O objetivo primário do estudo foi avaliar a mortalidade de todas as causas em 30 dias. Os objetivos secundários foi a avaliação de mortalidade por todas as causas em 6 meses e no fim do Estudo; Mudanças em índices ecocardiográficos de mobilidade de parede; índice de dilatação de VE e outras variáveis ecocardiográficas aferidas 2 semanas após a randomização e antes da alta hospitalar; mudança na qualidade de vida e capacidade física em 2 semanas após a alta e em 6 meses após o IAM.
Foram incluídos os pacientes com choque cardiogênico iniciados até 36 horas do IAM e a randomização deveria ocorrer até 12 horas do diagnóstico do Choque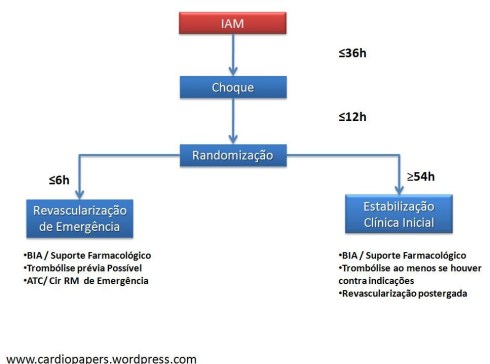
adaptado do www.medscape.com
O choque cardiogênico ocorreu em média 5 horas após o IAM no grupo de revascularização e 6,5h no grupo de tratamento clínico inicial.
Os indivíduos em choque cardiogênico tiveram comprometimento significatico de TCE em 20% dos pacientes e lesão triarteriais em 64% evidenciando uma FEVE média de 31% ( ventriculografia).
O suporte farmacológico com vasopressores/inotrópicos e BIA foi recomendados para todos os grupos e iniciados tão precoce fosse realizado o diagnóstico do choque.
Os pacientes do grupo revascularização deveriam ser submetidos a cineangiocoronariografia, idealmente em menos de 6 horas da randomização. O método de revascularização ( angioplastia ou Cirurgia de revascularização ) foi individualizado seguindo julgamento de um grupo de hemodinamicistas e cirurgiões. No grupo de tratamento clínico a revascularização deveria ocorrer com tempo mínimo de estabilização de 54 horas.
A angioplastia era preferida nos pacientes com Lesão de 1 ou 2 vasos e o objetivo era a recanalização com fluxo TIMI 3 da artéria CULPADA. Nos pacientes triarteriais importantes ( lesão 100% + 2 lesões >90%), lesão em TCE ou falha da angioplastia, a cirurgia de revascularização completa era preferida. Apesar dos pacientes submetidos a revascularização cirurgicas apresentarem doença arterial mais severa a mortalidade entre as duas modalidades foi semelhante.
Como resultado, observou-se que não houve diferenças estastísticas na mortalidade em 30 dias. Porém em 6 meses a estratégia de revascularização de emergência foi claramente superior, salvando 13 vidas para cada 100 pacientes tratados (50.3 % vs. 63.1 % P=0.027)., mantendo benefícios em 1 ano de seguimento. O benefício foi iminentemente observado em pacientes com menos de 75 anos, que nesse grupo chega a 20 vidas salvas em 6 meses por 100 pacientes tratados. No pacientes com mais de 75 anos a estratégia de revascularização emergêcia foi deletérias.
Após este estudo, guidelines da ACC/AHA e diretrizes ao redor do mundo incluiram como classe I de recomendação a estratégia de revascularização precoce na população de choque cardiogênico secundário a IAM com supra com as características acima.
REFERÊNCIA:
Revisão clínica: Ticagrelor
22 jan
O ticagrelor é uma medicação anti-plaquetária que age de forma diferente do clopidogrel e do prasugrel (pertencentes a classe dos tienopiridínicos). Apesar das 3 medicações terem o mesmo mecanismo de ação (inibição do receptor plaquetário P2Y12) o ticagrelor tem efeito reversível enquanto que os tienopiridínicos atuam de forma irreversível.
A medicação foi avaliada no estudo PLATO (Platelet Inhibition and Patient Outcomes) publicado na New England em 2009. Neste trial foram randomizados 18.624 pctes em 43 países diferentes do mundo com síndrome coronariana aguda tanto com quanto sem supra de ST. Os indivíduos eram então randomizados para receber clopidogrel (dose de ataque de 300-600 mg e manutenção de 75 mg) ou ticagrelor (180 mg de ataque e manutenção de 90 mg 2xd) durante 1 ano. Todos os pctes recebiam AAS (75-100 mg/d) a não ser que não tolerassem a medicação. O end-point primário do estudo era o desfecho composto de morte por causas vasculares + AVC + reinfarto tendo ocorrido em 11,7% dos pctes que usaram clopidogrel e em 9,8% dos pctes recebendo ticagrelor (redução de 16%). Os end-points secundários incluíam a análise isolada de morte por causa cardiovasculares, AVCi e IAM. Observou-se DIMINUIÇÃO DE 21% DA MORTALIDADE por causas cardíacas (saiu de 5,1% para 4%) e de 16% do risco de IAM. Não houve diferença de AVC. Para cada 1.000 pctes tratados com ticagrelor ao invés de clopidogrel houve uma diminuição de 14 mortes, 11 infartos e 8 tromboses de stent. Interessante que NÃO HOUVE AUMENTO DE SANGRAMENTOS de uma forma geral com o uso do ticagrelor.
No subestudo do PLATO que analisou os pctes do trial que foram encaminhados para a cirurgia (<5% dos casos) notou-se um dado interessante. Apesar de não ter havido diminuição do risco de sangramento, IAM ou AVC no grupo do ticagrelor, observou-se uma importante diminuição da mortalidade tanto por causas cardiovasculares quanto por causas gerais. Esta redução ficou em torno de 50%. Começou-se a questionar se a droga poderia ter efeitos pleotrópicos que justificassem o achado mas isto ainda será motivo de muito debate.
Um dado interessante é que o fato do ticagrelor ter efeito reversível tem, como tudo na vida, um lado bom e um possivelmente deletério. A principal vantagem da reversibilidade da medicação é provavelmente o fato de poder-se usá-la de forma upstream (já na sala de emergência, antes de realização do cateterismo). Isto porque caso o cate mostre posteriormente que trata-se de caso cirúrgico é só suspender a medicação por 2 ou 3 dias e encaminhar o pcte para o procedimento, sem aumentar assim o seu risco de sangramento. Já quando usa-se o clopidogrel e o prasugrel este período sobre para 5 e 7 dias, respectivamente. Devido a este fato inúmeros serviços optam por administr r o clopidogrel apenas na sala de hemodinâmica, após ter-se descartado que o caso seja de indicação cirúrgica. bem, mas como nem tudo são flores a reversibilidade do ticagrelor pode ter um efeito possivelmente maléfico. Sabe-se que a aderência dos pctes às medicações prescritas está bem longe do esperado. A questão é que com o ticagrelor a omissão de 3 a 4 doses da medicação já pode aumentar bastante o risco de trombose de stent. Já com o clopidogrel só começa a haver aumento significativo do risco de trombose após 3 a 5 dias da suspensão da droga. Ou seja, pctes mal aderentes são um grupo potencialmente complicado para receberem o ticagrelor a longo prazo.
Um outro possível uso do ticagrelor seria como “medicação-ponte” nos pctes que vem em uso de clopidogrel ou prasugrel e precisam ser operados por algum motivo. Explicando melhor: o que fazer com um pcte que colocou um stent farmacológico há 4 meses e descobriu ser portador de neoplasia gástrica necessitando ser submetido a gastrectomia o mais breve possível? Sabemos que nos pctes portadores de stent farmacológico a dupla antiagregação tem que ser mantida idealmente por pelo menos 1 ano. Ao parar-se o clopidogrel por um certo período ocorre um aumento exponencial do risco de trombose de stent. Ironicamente a maioria dos cirurgiões recusa-se a operar pctes em uso de clopidogrel devido ao risco aumentado de sangramentos. O que fazer? Apesar desta pergunta ainda não possuir resposta clara uma alternativa que vem sendo estudada é a possibilidade de se usar um outro antiplaquetáriocomo efeito de ponte entra a suspensão do clopidogrel e a realização da cirugia. Isto já foi feito com antagonistas 2b3a venosos. Suspende-se o clopidogrel 5 dias antes da cirurgia, iniciando-se logo apos o uso de tirofiban. Esta medicação é desligada 4-8 hrs antes da cirurgia. Assim o pcte fica “descoberto” durante curto período de tempo antes do procedimento. O mesmo princípio valeria para o ticagrelor. Suspender-se-ia o clopidogrel 5 dias antes iniciando-se de forma concomitante o ticagrelor. Este por sua vez poderia ser suspenso 2 a 3 dias antes da cirurgia. Este possível efeito do ticagrelor ainda não foi estudado em trials mas isto é questão de tempo.
Não há necessidade ajuste da dose em idosos. Nos pctes >75 anos a medicação não apresentou benefício em relação ao clopidogrel. Não é necessário ajuste pela função renal, contudo, como não foi estudado em pctes dialíticos deve-se evitar o uso de ticagrelor neste subgrupo. O mesmo pode-se dizer de pctes com hepatopatia moderada/grave.
Contra-indicações:
1- Alergia a medicação
2- Passado de AVCH
3- Hemorragia ativa
4- Hepatopatia moderada/grave
5- Pctes em diálise
6- Pctes em uso de inibidores potentes do CYP3A4 (por ex. cetoconazol, claritromicina, nefazodona, ritonavir e atazanavir)
7- Plaquetopenia importante
Como havia relato prévio de pausas ventriculares exacerbadas pelo ticagrelor, pctes com risco aumentado de bradicardia sintomática (ex: doença do nó sinusal sem marcapasso implantado, BAV de segundo ou terceiro graus, etc) foram excluídos do PLATO.
Houve aumento de dispnéia com o uso do ticagrelor no PLATO (14,2% dos pctes x 9,2% dos indivíduos que usaram clopidogrel). O motivo disto é desconhecido. 1 em cada 100 pctes do PLATO que usaram o ticagrelor tiveram que parar a medicação devido ao sintoma. Pctes com asma e DPOC têm maior risco de desenvolver dispnéia secundária a droga e assim a medicação deve ser utilizada com cautela nestes casos.
A medicação já foi aprovada na Europa mas recentemente teve seu lançamento cancelado no Estados Unidos. Isto deveu-se ao fato de a análise dos 1.814 pctes do PLATO provenientes dos Estados Unidos e do Canadá ter mostrado que nesta população paradoxalmente houve aumento do desfecho primário. Qual o motivo da medicação ter efeitos tão benéficos em outros países (incluindo o Brasil) e terminar atuando de forma inversa no principal mercado do mundo? Enquanto não há resposta clara o FDA mantém a aprovação da droga nos USA cancelada.
Candesartan vs Losartan – podemos acreditar no efeito de classe dos BRA?
21 jan
Os bloqueadores do receptor de angiotensina II (BRA) diminuem mortalidade e hospitalização em pacientes com insuficiência cardíaca (IC) com fração de ejeção reduzida.
Isso já foi mostrado em vários estudos. O VAL-Heft (2001), mostrou o benefício no end-point combinado mortalidade + hospitalização do uso de Valsartan associado ao IECA; o CHARM-Added (2003) também mostrou benefício da associação BRA + IECA, nesse caso com Candesartan; e o CHARM-Alternative (2003) mostrou benefício no end-point combinado mortalidade + hospitalização do uso do Candesartan naqueles que não toleram IECA. Todos esses estudos incluíram pacientes com FE ≤ 40%, sintomáticos.
Mas será que podemos usar esses achados para qualquer droga dessa classe? Podemos acreditar num efeito de classe dessas medicações?
Sabe-se que as drogas do grupo dos BRA tem afinidades diferentes pelo receptor AT1, o que poderia levar a efeitos clínicos variáveis, mas nenhuma droga havia sido comparada com outra desse mesmo grupo.
Um estudo apresentado no JAMA avaliou um registro de IC (Swedish Heart Failure Registry) de 30.254 pacientes, entre 2000 e 2009. Desses, 5.139 pacientes estavam em uso de candesartan (2.639) ou losartan (2.500).
O desfecho primário foi mortalidade por qualquer causa em 1 ano e em 5 anos. Em 1 ano, a sobrevida no grupo Candesartan foi de 90% vs 83% do grupo Losartan, e em 5 anos, 61% vs 44% (P <0,001). Aqueles que usavam Losartan tiveram 43% maior chance de morrer do que quem usava Candesartan (hazard ratio 1,43 – 95% IC, 1,23-1,65; p 0,001).
Quando avaliados as características dos grupos, os pacientes do grupo Candesartan era mais jovens e tinham IC menos grave que o grupo Losartan, e usavam mais drogas com evidências de benefício em mortalidade, como IECA e betabloqueador. Além disso, havia uma maior prevalência de pacientes com FA, DM e doença pulmonar no grupo Losartan.
O resultado desse estudo coloca em dúvida o efeito de classe dos BRA. Com isso, achados de um estudo com um determinado BRA não deveriam ser generalizados para outros medicamentos dessa classe.
Os autores sugerem que esses achados não são fortes o suficiente para afetar a decisão clínica, e que essa evidência seria mais exploratória que definitiva. São necessários novos estudos comparando diretamente essas drogas. Enquanto aguardam esses estudos, sugerem, se possível, dar preferência ao candesartan.
Devemos lembrar que esse é um estudo observacional, e não um estudo prospectivo, randomizado, duplo-cego. Além disso, dos 6 autores, 4 tem conflito de interesse com a empresa Astra-Zeneca, que produz o Atacand® (Candesartan). Novos estudos clínicos comparando diferentes drogas dessa mesma classe poderiam esclarecer de forma mais consistente essa dúvida.
Referência: Cervenka ME, Benson L, Dahlström U, Edner M, Rosenqvist M, Lund LH. Association of Candesartan vs Losartan with All-Cause mortality in patients with heart failure. JAMA 2011;305(2):175-182.
Sangramento Digestivo Alto no pcte em uso crônico de AAS – o que fazer?
19 janOcasionalmente nos deparamos com o cenário de sangramento digestivo mediados por úlceras gástricas no pacientes que fazem uso crônico da aspirina tanto na prevenção primária de eventos cardiovasculares, quanto naqueles que a recebem para prevenção secundária ou estão em uso de antiagregantes devido a procedimentos percutâneos.
Antes de discutir sobre o que fazer em relação ao aas durante episódio de sangramento digestivo agudo, revisaremos as medidas que podemos tomar para evitar hemorragia digestiva alta (HDA) em pctes usuários crônicos de AAS.
1- Associação de Aspirina com protetores gástricos: Tanto inibidores de Bomba de Prótons (PPI) como Antagonistas H2 são eficazes em reduzir o risco, porém os PPI são bem mais efetivos neste contexto e são as medicações de escolha na prevenção de sangramento digestivos. As Três principais sociedades médicas Americanas já recomendam a utilização de protetores gástricos em todos aqueles pacientes com fatores de risco para Hemorragia digestiva alta e que utilizarão o AAS cronicamente.
FATORES DE RISCO PARA SANGRAMENTO RELACIONADO A ANTIPLAQUETÁRIOS: Sangramentos digestivos prévio ( principal); Presença de úlcera péptica conhecida; Idade avançada; Uso concomitante de anticoaculantes, estoróides e AINES; Pacientes infectados com H. plylori
2- Mudança para Clopidogrel (controverso): Existem poucas evidências clínicas para esta atitude e muito se baseia em plausibilidade biológica que o clopidogrel não atuaria nas prostaglandinas gástricas, porém 2 estudos de caso controles revelam riscos de sangramentos similares entre clopidogrel e AAS em baixas doses ( 70-100mg). Além disto, em um clinical trial, evidenciou que AAS + inibidor de bomba ( esomeprazol ) foi mais efetivo em reduzir o risco de sangramento do que o clopidogrel isoladamente em um acompanhamento de 1 ano ( incidência de sangramento com clopidogrel de 8,6% x 0,7 % com AAS + PPI) . Portanto dá-se preferência, mais uma vez, a associar um PPI a aspirina
3- Erradicação do H. pylori : O H. plylori é associado a sangramento digestivo alto. A evidência para a sua erradicação em pctes usuários crônicos de AAS é limitada, porém ainda é recomendada nos principais Guidelines.
Mas e se, apesar de todos os cuidados, o pcte vier a apresentar hemorragia digestiva alta na vigência do uso do AAS? O que fazer? O principal neste cenário é avaliar o motivo pelo qual o AAS foi iniciado. Um pcte que está usando AAS como prevenção primária devido a um escore de Framingham de 21% apresenta muito menos benefício de permanecer em uso de AAS do que um indivíduo que colocou um stent farmacológico há 3 semanas. Para uniformizar a conduta, propõe-se o algoritmo a seguir:
OBS:
- PPI utilizado foi o Pantoprazol e quando usado por via intravenosa, manteve-se infusão de 8mg/h por 72 horas. Após tratamento, os paciente foram mantido com protetores gástricos indefinidamente.
- No Ultimo consenso a respeito do uso de PPI e clopidogrel publicado em 2010, a interação entre estas duas medicações ainda encontra-se inconsistente e no grupo de pacientes de alto risco para sangramento, principalmente aqueles que já sangraram a balança RISCO x BENEFÍCIO pende para a recomendação da associação, corroborando a publicação acima.
REFERÊNCIAS:
Should Prophylactic Low-dose Aspirin Therapy be Continued in Peptic Ulcer Bleeding?
J Am Coll Cardiol, 2010; 56:2051-2066, doi:10.1016/j.jacc.2010.09.010
Amiodarona x Tireóide: o que o cardiologista precisa saber
19 jan
– A toxicidade tireodiana da amiodarona ocorre por sua molécula ser rica em iodo. Um único comprimido de 200mg de amiodarona tem 20x a quantidade de iodo de uma dieta americana típica
– É uma droga extremamente lipofílica: assim sua eliminação corporal tem meia vida de 100 dias
– Disfunção tireoidiana ocorre em 15-30% dos pacientes que usam a droga a depender de disfunção tireodiana prévia, dose utilizada.
– Achados habituais em pacientes com função tireoidiana normal após início de tratamento com amiodarona: aumento de T4 e T4L, redução de T3 e aumento de T3 reverso e leve aumento de TSH. Todos esses achados são atenuados com uso contínuo da droga. Em indivíduos que já tenham doença tireodiana é comum ocorrer hipotireoidismo em quem já tem doença de Hashimoto e hipertireoidismo naqueles que já tenham bócio multinodular ou Graves.
Hipotireoidismo
-como já comentado é esperado que haja uma leve alteração da função tireoidiana no início do tratamento, assim para o diagnóstico definitivo de hipotireoidismo é necessário que T4l baixo e TSH alto estejam persistentemente alterados (além de 6 meses do início do tratamento)
– tratamento: habitual com levotiroxina sem necessidade de alterar a amiodarona
Hipertireoidismo:2 tipos de tireotoxicose induzida por amiodarona (AIT)
– AIT tipo I: aumento da síntese hormonal por presença de doença tireoidiana intrínseca prévia
– AIT tipo II: tireoidite destrutiva levando a liberação de hormônios tireoidianos pré formados
– Quadro clínico: pode ser mascarado pela atividade cronotrópica negativa da amiodarona. Deve ser suspeitado se houver retorno ou falta de controle da arritmia bem como piora de sintomas de insuficiência cardíaca
– Diagnóstico diferencial entre as duas formas: não é feito através da cintilografia de tireóide, porque uma vez que o paciente está em uso de amiodarona, as altas concentrações de iodo da droga vão competir com o I radioativo e isso atrapalha a captação do I radioativo alterando o resultado do exame ( como seria esperado em pacientes sem uso de amiodarona: aumento da captação na doença com aumento da produção e captação ausente na tireoidite destrutiva). Pode ser feito através do USG tireóide com doppler que vai mostrar aumento da vascularização nos casos de AIT tipo I e redução na AIT tipo II. Outro exame que pode auxiliar na distinção dos tipos são os auto- anticorpos tireoidianos: Anti TPO, TRAB que mais frequentemente são positivos na AIT tipo I já que se trata de uma produção aumentada numa glândula previamente doente.
– Tratamento:
- AIT tipo I: drogas antirireoidianas (tionamidas) são usualmente eficazes geralmente em maiores doses. A manutenção do uso da amiodarona deve ser reavaliada e outras drogas antiarríitmicas devem ser preferidas se possível
- AIT tipo II: glicocorticóides são o tratamento de escolha.
Revisão clínica: amiodarona
18 jan
– A amiodarona mostrou-se mais efetiva do que o sotalol e a propafenona para diminuir recorrência de FA. No Sotalol Amiodarone Atrial Fibrillation Efficacy Trial avaliaram-se 665 pctes com FA persistente. Os pctes eram randomizados para receber sotalol, amiodarona ou placebo. O que se viu foi que após 1 ano apenas 35% dos cptes usando amiodarona apresentaram recidiva da arritmia enquanto o mesmo ocorreu em 60% dos pctes usando sotalol e em 82% dos pctes usando placebo.
– Como a amiodarona é uma droga muito lipofílica ela pode demorar até 6 meses para ser eliminada do corpo após o término do uso. Como é transformada em seu metabólito ativo no fígado, seu uso deve ser evitado em casos de hepatopatia avançada. Seu metabolismo não é afetado por disfunção renal e assim pode ser usada até em pctes dialíticos. Deve ser evitada em gestantes e lactantes uma vez que é excretada no leite materno e cruza a placenta.
– Contra-indicações absolutas: disfunção importante do nó sinusal e doença avançada do sistema cardíaco de condução, a menos que o pcte já tenha marcapasso implantado. Evitar o uso em pneumopatias graves uma vez que um dos efeitos colaterais da medicação é o surgimento de fibrose pulmonar.
– Em pctes com CHA2DS2VASc maior ou igual a 1 é interessante que a anticoagulação plena seja obtida antes do início da amiodarona uma vez que a medicação pode induzir reversão do ritmo a qualquer momento, predispondo assim a eventos embólicos.
– A dose de impregnação da amiodarona geralmente fica ao redor de 10 gramas. Nas primeiras semanas de uso pode-se usar doses mais altas (ex: 200 mg 3x ao dia) para se chegar a esse total mais rapidamente. Antes de se iniciar a impregnação deve-se realizar ecg para avaliar o intervalo Qtc corrigido. Durante a fase de impregnação, repetir pelo menos 1x o eletro para observar se a droga está causando bradicardia importante ou aumento excessivo do Qtc. Este último efeito se deve ao fato da amiodarona inibir os canais de potássio.
– Após a dose de impregnação ter sido realizada, a manutenção da amiodarona costuma ser de 200 mg/d.
– Ao iniciar amiodarona em pctes que vem em uso de varfarina ou de digoxina deve-se diminuir em 50% a dosagem de tais medicações.
– O efeito colateral cardíaco mais comum da amiodarona é a bradicardia. Apesar de poder haver aumento do intervalo Qt, a incidência de torsades de pointes é pequena.
– Hipotireoidismo secundário a amiodarona é comum mais geralmente não necessita que se are o uso da medicação. Reposição com levotiroxina corrige o distúrbio. Já hipertireoidismo é menos comum mas quando ocorre deve indicar interconsulta com o endocrinologista. Escreveremos mais a frente um tópico sobre os tipos de tireotoxicose que a amiodarona pode causar e qual o manejo adequado para cada um.
– Deve-se dosar TSH antes do início do tratamento com amiodarona e após isto a cada 6 meses.
– A toxicidade pulmonar é a principal causa de morte secundária ao uso de amiodarona. Apesar de haver casos de toxicidade aguda, o mais comum é a presença de pneumopatia intersticial crônica relacionada a dose total de amiodarona usada. Este quadro costuma surgir apenas meses/anos após o início do uso da medicação. Como a droga é lipofílica e demora para ser eliminada do corpo, os efeitos pulmonares podem continuar progredindo mesmo após a total suspensão da amiodarona. Recomenda-se fazer radiografia de tórax e espirometria antes do início da amiodarona. No acompanhamento, realiza-se radiografia de tórax anualmente ficando a prova de função pulmonar reservada para os pctes que desnvolvem sintomas sugestivos de pneumopatia.
– Amiodarona pode causar NASH (estato-hepatite não alcoólica). Monitorizar TGO/TGP antes do início do uso e após, a cada 6 meses.
– Amiodarona pode causar depósitos na córnea assim como neuropatia óptica. Contudo, raramente é causa de sintomas oftalmológicos. Caso surjam sintomas durante o uso da medicação, solicitar interconsulta da oftalmo para descartar outros problemas.
– Em relação aos efeitos dermatológicos, a droga pode causar fotossensibilidade e coloração azulada da pele.
Referência: Amiodarone for Atrial Fibrillation. Zimetbaum P. The New England Journal of Medicine. Volume 356(9), 1 March 2007, pp 935-941
Qual o anti-inflamatório mais seguro em pctes cardiopatas?
15 jan
Metanálise lançada no BMJ em 11 de janeiro de 2011 avaliou as consequências do uso de anti-inflamatórios não hormonais(AINES) em relação a eventos cardiovasculares (IAM, AVCi, morte por doença cardiovascular). Foram avaliados 31 estudos que englobaram um total de 116.429 pctes. O que se viu que foi que todas as medicações estudadas (naproxeno, ibuprofeno, diclofenaco, celecoxib, etoricoxib, lumiracoxib, rofecoxib) causaram aumento de eventos cardiovasculares. É mais um estudo que corrobora que todos os AINES aumentam o risco cardiovascular dos pctes. Nesta metanálise a medicação que acarretou menor aumento de eventos cardiovasculares foi o naproxeno. Isto condiz com estudo publicado em 2009 no circulation em que o grupo chefiado pelo Dr Wayne Ray avaliou um total de 48.566 pctes através de uma coorte retrospectiva, mostrando ao final que o naproxeno era o AINE com perfil cardiovascular mais favorável.
O importante é saber que o ideal é evitar por completo esta classe de medicações em pctes com risco cardiovascular aumentado. No manejo de dores crônicas deve-se priorizar outros grupos de medicações (paracetamol, opióides fracos, etc). Caso seja fundalmental o uso de AINES, tentar usar a medicação pelo menor tempo possível, na menor dose que controle os sintomas do pcte. Priorizar nestes casos o uso de naproxeno, baseado nas evidências que dispomos até o momento.
Referência: Trelle S, Reichenbach S, Wandel S, et al. Cardiovascular safety of non-steroidal anti-inflammatory drugs: Network meta-analysis. BMJ 2011; DOI:10.1136/bmj.c7086.
Dupla antiagregação plaquetária após stent farmacológico: uma questão de vida ou morte!
14 jan
Os guidelines atuais que falam sobre o uso de dupla antiagregação plaquetária após o implante de stents farmacológicos são categóricos em afirmar que o aas + clopidogrel deve ser mantido por mínimo 12 meses após o procedimento. Estudo publicado esta semana no American Journal of Cardiology reforça mais uma vez o motivo disto. Foram acompanhados 1.358 pctes submetidos ao implante de stent farmacológico durante um período de 36 meses. Todos eram liberados do hospital em uso de dupla antiagregação e orientados a usar a medicação pelo período mínimo de 1 ano. O que se viu é que 8,8% dos pctes haviam parado de tomar uma das ou as duas medicações após 1 ano de acompanhamento. Ou seja, praticamente 1 em cada 10 pctes não seguiu a recomendação médica. Pode parecer pouco, mas ao olharmos para o resultado é fácil de perceber que isto pode ser a diferença entra a vida e a morte.
No grupo que manteve a dupla antiagregação a mortalidade de causas cardiovasculares após um ano foi de 1,2%. Já no grupo que não seguiu o regime terapêutico sugerido a mortalidade foi de 5%. Este aumento de mortalidade ocorreu basicamente às custas de trombose aguda de stent, como era de se esperar (aumentou de 3,4% para 7,6% devido a ausência de dupla antiagregação). O risco cardiovascular aumentava apenas quando a parada do uso de uma das medicações ocorria por um período maior do que 5,5 dias. Isto provavelmente se deve ao fato de que tanto o aas quanto o clopidogrel mantém efeito antiplaquetário por 5 a 7 dias (daí a recomendação de parar o clopidogrel 5-7 dias antes de cirurgias eletivas).
Em muitos dos casos de discontinuação o motivo foi a orientação de outros médicos (não cardiologistas) ou de odontologistas devido a realização de procedimentos invasivos.
Pontos importantes que tiramos do estudo:
1- Os pctes têm que ser orientados sobre a fundamental importância de usar o aas e clopidogrel rigorosamente por pelo menos 1 ano após o implante de stents farmacológicos. Deve-se deixar explícito que caso não sigam tal recomendação HÁ RISCO DE MORTE.
2- Os pctes devem ser orientados suspender o uso do aas e/ou do clopidogrel apenas após orientação de médico habilitado, de preferência o cardiologista que o acompanha. Se houver necessidade de realização de procedimento cirúrgico no primeiro ano após o implante de stent farmacológico o cardiologista deve avaliar qual a conduta adequada – suspender o procedimento caso não seja fundamental? Fazer o procedimento em vigência de dupla antiagregação? Parar o clopidogrel 5 dias antes e fazer “ponte com tirofiban” até a realização do procedimento? São várias as alternativas mas sempre o cardiologista deve estar envolvido na decisão final.
Referência: Rossini R, Capodanno D, Lettieri C, et al. Prevalence, predictors, and long-term prognosis of premature discontinuation of oral antiplatelet therapy after drug eluting stent implantation. Am J Cardiol 2011; 107:186-194
Dronedarona e Lesão Hepática. Qual o verdadeiro lugar desta medicação?
14 jan
A Dronedarona vem sendo comentada aqui há algum tempo. Esta medicação nasceu como uma alternativa para o uso da amiodarona, com menos efeitos adversos, mas este fim não foi plenamente alcançado. Como comentado no post anterior, a sua eficácia no controle da FA comparada com amiodarona decepcionou, como observado no Estudo DYONYSUS que revelou recorrência da FA em 53% dos pctes que usaram dronaderona e em 42% do grupo da amiodarona. Quando avaliada a tolerância e efeitos colaterais, a dronaderona não convenceu, pois foi demonstrado uma incidência de 10,4 % de abandono com a dronaderona e no grupo amiodarona a descontinuidade foi de 13,3%. Será que a diferença de tolerabilidade compensa o déficit na eficácia entre as duas drogas?
Lembro também do Estudo clínico ANDROMEDA que foi interrompido precocemente por aumento de mortalidade nos pacientes com insuficiência cardíaca com descompensação recente ou com disfunção sistólica grave.
A Sanofi-Aventis ( indústria responsável pelo MULTAQ – Dronaderona) divulgou um alerta quanto ao risco de indução de lesão hepática grave relacionada ao uso do antiarrítmico que incluiram 2 casos de necessidade de transplante hepático. A empresa descreve a possibilidade de alterações nas provas laboratórias de lesão hepática, porém enfatiza que não existem dados suficientes para correlação causal inequívoca entre a droga e a lesão hepática.
Em conssonância, o FDA também divulgou hoje ( 14/01/11) uma comunicação de segurança que estimula os profissionais de saúde solicitarem testes periódicos de função hepática em doentes que tomam dronedarona, especialmente nos primeiros seis meses de tratamento, além de orientarem os pacientes a relatar quaisquer sintomas sugestivos de lesão hepática imediatamente.